 ÁCIDOS
ÁCIDOS
 ÁCIDOS
ÁCIDOS



Ácidos no cotidiano: ácido acético - vinagre, ácido cítrico - frutas cítricas.
Introdução
Desde os tempos dos alquimistas, observou-se que certas substâncias apresentavam comportamentos peculiares quando dissolvidos na água. Entre tais propriedades destacavam-se:
| o sabor azedo facilmente identificado em frutas cítricas, como limão, laranja e maçã (a palavra ácido é proveniente do latim acidus - azedo, picante); | |
| formar soluções aquosas condutoras de eletricidade; | |
| provocar efervescência, quando em contato com o calcário; | |
| produzir mudança de cor nos indicadores ácido-base. |
Essas substâncias foram denominadas ácidos.
Os ácidos estão presentes em nosso dia-a-dia, como por exemplo: a laranja, o limão e as demais frutas cítricas contém ácido cítrico, a bateria de um automóvel contém ácido sulfúrico, o vinagre contém ácido acético, o ácido clorídrico é constituinte do suco gástrico no estômago, o ácido nítrico é utilizado para produzir explosivos como o TNT.
De um modo geral os ácidos são tóxicos e corrosivos, portanto deve-se evitar contato com a pele, ingeri-los ou respirá-los.Definição Segundo Arrhenius
Ácido é todo composto molecular que, em solução aquosa, se ioniza, produzindo exclusivamente como cátion o H3O+ (hidroxônio).
HCl + H2O
HCN + H2O
No entanto, o cátion Hidroxônio (H3O+) pode ser representado por H+:
HCl
HCN
Classificação dos Ácidos
Quanto à natureza do ácido
Orgânicos - são compostos que contêm em sua estrutura o grupamento carboxila, composto por um átomo de carbono ligado a um átomo de oxigênio por ligação dupla e a um grupo de hidroxila, por ligação simples:
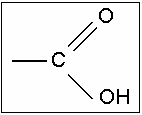
carboxila
O grupo carboxila também pode ser representado apenas por:
-COOH
O hidrogênio ligado ao átomo de oxigênio do grupo carboxila é considerado o hidrogênio ionizável do ácido, desta forma na sua ionização, teremos:
-COOH → H+ + -COO-
Entre os milhares de ácidos orgânicos conhecidos, alguns são de enorme importância para o homem, como por exemplo:COOH à ácido fórmico (proveniente das formigas)
CH3COOH à ácido acético (extraído no vinagre, acetum – azedo)
Inorgânicos ou minerais - são de origem mineral e dividem-se em hidrácidos e oxiácidos.
Ex.: HCl, HF, HCN, H2SO4, H3PO4, et
Quanto à presença de oxigênio na molécula
Hidrácidos – não possuem oxigênio
Exemplos: HCl, HCN, HF, HI, HBr, H2S, etc.
Oxiácidos – possuem oxigênio
Exemplos: HNO3 , HClO3 , H2SO4, H3PO4, etc.
Quanto ao número de hidrogênios ionizáveis
Monoácidos (ou monopróticos) – apresentam um hidrogênio ionizável.
Exemplos: HCl, HBr, HNO3 , H3PO2 (exceção).
Diácidos (ou dipróticos) – apresentam dois hidrogênios ionizáveis.
Exemplos: H2S, H2SO4 , H3PO3 (exceção).
Triácidos – apresentam três hidrogênios ionizáveis.
Exemplos: H3PO4 , H3BO3.
Tetrácidos – apresentam quatro hidrogênios ionizáveis.
Exemplos: H4SiO4 , H4P2O7.
Quanto ao número de elementos químicos
Binário – dois elementos químicos diferentes.
Exemplos: HCl, H2S, HBr.
Ternário – três elementos químicos diferentes.
Exemplos: HCN, HNO3 , H2SO4 .
Quaternário – quatro elementos químicos diferentes.
Exemplos: HCNO, HSCN
Quanto à volatilidade (ponto de ebulição)
Observação: Por quê se deixarmos um recipiente aberto contendo éter, em pouco tempo, observa-se que o éter desaparecerá?
O éter é um líquido que possui baixo ponto de ebulição e evapora com facilidade à temperatura ambiente. Dizemos neste caso que o éter é uma substância volátil.
Um outro exemplo comum ocorre com o vinagre, o qual possui um odor bastante pronunciado devido à volatilidade do ácido acético, seu principal constituinte.
Ácidos voláteis - ácidos com baixo ponto de ebulição (PE).
Ex.: todos os hidrácidos (HCl, HF, HI, HBr, HCN, H2S), HNO3, HCOOH e CH3COOH.
Ácidos fixos - ácidos com elevado ponto de ebulição (PE).
Ex.: H2SO4 (PE = 340ºC), H3PO4 (PE = 213ºC) e H3BO3 (PE = 185ºC).
Quanto ao grau de ionização (força de um ácido)
Ácidos fortes: possuem α > 50%
Ácidos moderados: 5%
 α
α  50%
50%Ácidos fracos: α < 5%
Regra Prática para Determinação da Força de um Ácido
I. Hidrácidos
Ácidos fortes: HI > HBr > HCl.
Ácido moderado: HF.
Ácidos fracos: demais.
II. Oxiácidos
Sendo HxEzOy a fórmula de um ácido de um elemento E qualquer, temos

se:
m = 3
 ácido muito forte
ácido muito forteExemplos: HClO4 , HMnO4...
m = 2
 ácido forte
ácido forteExemplos: HNO3 , H2SO4...
m = 1
 ácido moderado
ácido moderadoExemplos: H3PO4 , H2SO3 , H3PO3(2 H+), H3PO2(1 H+)
m = 0
 ácido fraco
ácido fracoExemplos: HClO, H3BO3
Observação
1º) O ácido carbônico (H2CO3) é uma exceção, pois é um ácido fraco (α = 0,18%), embora o valor de m = 1
2º) Todos os ácidos carboxílicos são fracos.
Fórmula Estrutural
I. Hidrácidos ( HxE )
Cada hidrogênio está ligado ao elemento por um traço (–) que representa a ligação covalente.

Exemplos
Exemplos
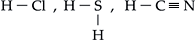



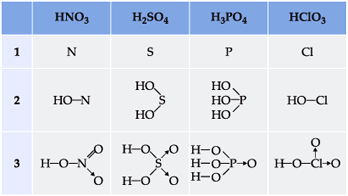
Para escrever a fórmula estrutural dos oxiácidos, devemos proceder da seguinte maneira:
1) escrever o elemento central;
2) ligar o elemento central a tantos grupos – OH quantos forem os hidrogênios ionizáveis;
3) ligar o elemento central aos oxigênios restantes através de uma dupla ligação ou por ligação dativa
Exemplos
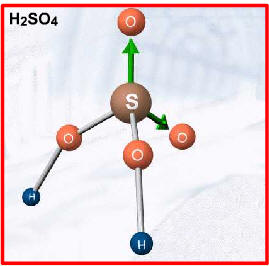
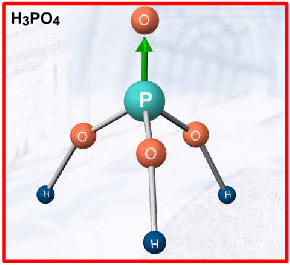
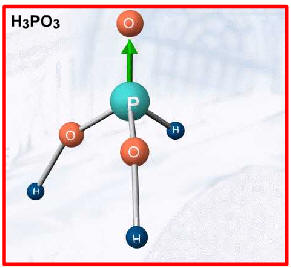
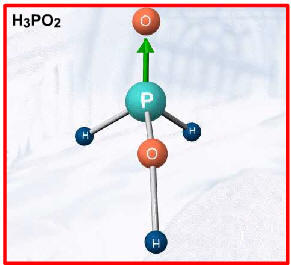
Duas exceções importantes, por apresentarem hidrogênios não-ionizáveis, são:
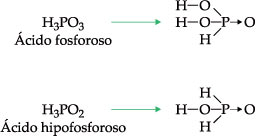
I. Formulação
O ácido é formado pelo cátion H+ e ânion qualquer (Ax-). Portanto, podemos representar sua fórmula da seguinte maneira:
H+Ax- 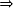 HxA
HxA
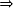 HxA
HxAII. Nomenclatura
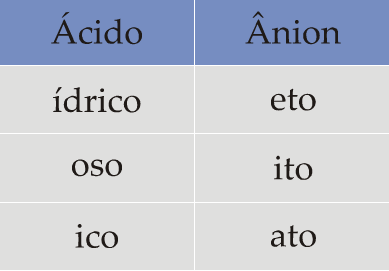
O nome de um ácido é feito basicamente da seguinte forma:
1o) a palavra ácido;
2o) nome do elemento;
3o) terminação ídrico, ico ou oso
Hidrácidos (HxE)
Exemplos
HCl 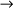 ácido clorídrico
ácido clorídricoHBr
 ácido bromídrico
ácido bromídricoHCN
 ácido cianídrico
ácido cianídricoH2S
 ácido sulfídrico
ácido sulfídricoHI
 ácido iodídrico
ácido iodídricoOxiácidos (HxEzOy)
Neste caso, como o mesmo elemento pode formar vários oxiácidos, estabelecemos um oxiácido padrão a partir do qual daremos nomes aos demais.
• Oxiácido padrão
ácido nome de E ico
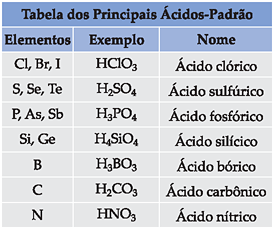
Regra geral para elementos que formam 2 ou mais oxiácidos:
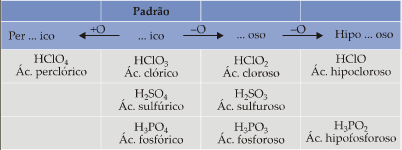
Como vemos na tabela acima, todo oxiácido padrão tem terminação ico. Se tivermos um ácido com:
a) um oxigênio a mais que o padrão, acrescentamos o prefixo per;
b) um oxigênio a menos que o padrão, a terminação muda para oso;
c) dois oxigênios a menos que o padrão, a terminação continua oso e acrescentamos o prefixo hipo.
Resumindo temos:

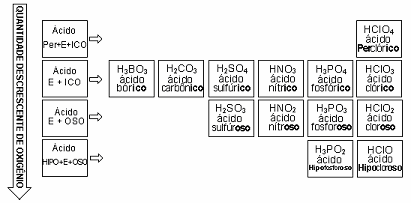
Regra quando varia o grau de hidratação
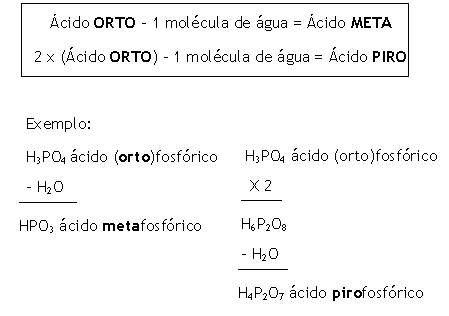
Resumindo temos:
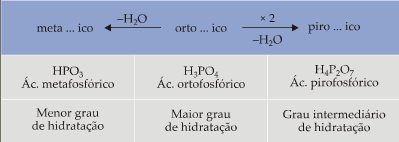
Exemplos
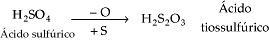
Ionização dos Ácidos
A ionização de um ácido, como já vimos anteriormente, na própria definição de ácido de Arrhenius, é a reação do ácido com a molécula de água, produzindo o cátion H3O+.
Se um ácido possui dois ou mais hidrogênios ionizáveis (poliácido), a ionização ocorre em etapas.
Exemplos
a)
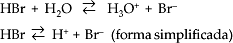
b)
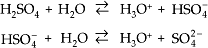
c)
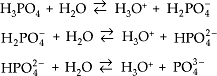
d)
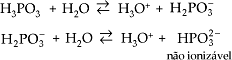
e)
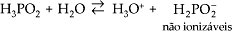
Nomenclatura dos Ânions
Podemos considerar que os ânions são provenientes dos ácidos.
Assim, temos:
HF = ácido fluorídrico → F- = fluoreto
HCl = ácido clorídrico → Cl- = ânion cloreto
HBr = ácido bromídrico → Br- = ânion brometo
HI = ácido iodídrico → I- = ânion iodeto
HCN = ácido cianídrico → CN- = ânion cianeto
HNO3 = ácido nítrico → NO3- = ânion nitrato
HNO2 = ácido nitroso → NO2- = ânion nitrito
HClO3 = ácido clórico → ClO3- = ânion clorato
HClO4 = ácido perclórico → ClO4- = ânion perclorato
HClO2 = ácido cloroso → ClO2- = ânion clorito
HClO = ácido hipocloroso → ClO- = ânion hipoclorito
CH3COOH = ácido acético → CH3COO- = ânion acetato
HIDROGENO ÂNIONS
São ânions que possuem um ou mais hidrogênios ionizáveis em sua fórmula. Sua nomenclatura segue a seguinte regra:
Mono, di ou tri (nº de H ionizáveis) + hidrogeno + nome do ânion normal
Ou ainda:
Nome do ânion normal + mono, di ou tri (nº de H ionizáveis) + ácido
Observações:
1º) A colocação do prefixo mono é opcional;
2º) Os hidrogeno ânions provenientes de diácidos, o nome pode ser formado acrescentando-se o prefixo BI.
Exemplo 1:
H2S → H+ + HS-
HS- → H+ + S2-
Desta forma, teremos:
| H2S | HS- | S2- |
| Ácido sulfídrico | (Mono)Hidrogeno sulfeto Sulfeto (mono)ácido Bissulfeto | Sulfeto |
Exemplo 2:
H2SO4 → H+ + HSO4-
HSO4- → H+ + SO42-
Desta forma, teremos:
| H2SO4 | HSO4- | SO42- |
| Ácido sulfúrico | (Mono)Hidrogeno sulfato Sulfato (mono)ácido Bissulfato | Sulfato |
Exemplo 3:
H3PO4 → H+ + H2PO4-
H2PO4- → H+ + HPO42-
HPO42- → H+ + PO43-
Desta forma, teremos:
| H3PO4 | H2PO4- | HPO42- (*) | PO43- |
| Ácido Fosfórico | Di-hidrogeno fosfato Fosfato diácido | (Mono)Hidrogeno fosfato Fosfato (mono)ácido | Fosfato |
(*) Observe que para o hidrogeno fosfato não foi utilizado o prefixo BI, pois o ânion é proveniente de um triácido.
Exemplo 4:
H2CO3 → H+ + HCO3-
HCO3- → H+ + CO32-
Desta forma, teremos:
| H2CO3 | HCO3- | CO32- |
| Ácido carbônico | (Mono)Hidrogeno carbonato Carbonato (mono)ácido Bicarbonato | Carbonato |
Apesar de esses ânions apresentarem hidrogênios, estes não são ionizáveis
APLICAÇÕES DOS PRINCIPAIS ÁCIDOS DO COTIDIANO
Ø Ácido clorídrico (HCl)
Ø Ácido clorídrico (HCl)
· O ácido impuro (técnico) é vendido no comércio com o nome de ácido muriático;

Recipiente contendo ácido muriático
· É encontrado no suco gástrico, produzido pelas células parietais, responsável pela acidez estomacal;
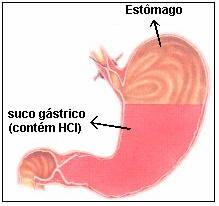
Esquema representativo do estômago contento suco gástrico (HCl)
· É um reagente muito usado na indústria e no laboratório;
· É usado na limpeza de pisos após a caiação das paredes (cal hidratada Ca(OH)2) , para remover os respingos de cal;
HCl(aq) + Ca(OH)2(s) → CaCl2(aq) + 2 H2O
Ø Ácido fluorídrico (HF)
· Tem a particularidade de corroer o vidro, devendo ser guardado em frascos de plástico, por esta razão é usado para fazer gravações sobre o vidro.
Vidro de um automóvel com gravação do número do chassi feita com HF
Ø Ácido cianídrico (HCN)· O HCN é o gás de ação venenosa mais rápida que se conhece: uma concentração de 0,3 mg por litro de ar é imediatamente mortal;
· É o gás usado nos estados americanos do Norte que adotam a pena de morte por câmara de gás;
· A primeira vítima do HCN foi seu descobridor, Carl Wihelm Scheele, que morreu ao deixar cair um vidro contendo solução de HCN.

Câmara de gás utilizado em execuções nos EUA
Ø Ácido sulfídrico (H2S)· O H2S é um gás incolor, mais pesado do que o ar e inflamável com um forte odor desagradável de ovos podres. Esse gás é algumas vezes referido como "gás de cano de esgoto". Em pequenas concentrações ele pode irritar os olhos e atuar como depressivo; em elevadas concentrações ele pode provocar irritação do sistema respiratório superior e, durante longas exposições, edema pulmonar. Sendo mais denso que o ar, o H2S pode acumular-se em depressões e cavernas.

Aquecendo as mãos no geiser (deserto chileno nos andes) que elimina H2S com odor de ovo podre.
Ø Ácido sulfúrico (H2SO4)· É o ácido mais utilizado e importante nas indústrias e nos laboratórios, conhecido como “burro de carga”. O poder econômico de um país pode ser avaliado pela quantidade de ácido sulfúrico que ele fabrica e consome;
· O maior consumo de ácido sulfúrico é na fabricação de fertilizantes, como os superfosfatos e o sulfato de amônio;
· É o ácido dos acumuladores de chumbo (baterias) usados nos automóveis;

Bateria automotiva contendo solução de H2SO4
· É consumido em enormes quantidades em inúmeros processos industriais, como processos da indústria petroquímica, fabricação de papel, corantes, etc;· O ácido sulfúrico concentrado é um dos desidratantes mais enérgicos. Assim, ele carboniza os hidratos de carbono como os açúcares, amido e celulose; a carbonização é devido à desidratação desses materiais;
C12H22O11(s)  12 C(s) + 11 H2O(v)
12 C(s) + 11 H2O(v)
Sacarose Carvão
Adicão de ác. sulfúrico ao açúcar com desidratação e formação de carvão com expansão de massa.
· O ácido sulfúrico "destrói" o papel, o tecido de algodão, a madeira, o açúcar e outros materiais devido à sua enérgica ação desidratante;· O ácido sulfúrico concentrado tem ação corrosiva sobre os tecidos dos organismos vivos também devido à sua ação desidratante. Produz sérias queimaduras na pele. Por isso, é necessário extremo cuidado ao manusear esse ácido;
· As chuvas ácidas em ambiente poluídos com dióxido de enxofre contêm H2SO4 e causam grande impacto ambiental.
S + O2(g) → SO2(g) + 1/2 O2(g) → SO3(g) + H2O(l) → H2SO4(aq)
impureza ar ar água da chuva chuva ácida
dos derivados
do petróleo



Efeitos da chuva ácida: estátua antes e depois da exposição à chuva ácida, floresta negra na Alemanha em 1970 e 1983 depois da exposição à chuva ácida.
Ø Ácido nítrico (HNO3)
· Depois do sulfúrico, é o ácido mais fabricado e mais consumido na indústria. Seu maior consumo é na fabricação de explosivos, como nitroglicerina (dinamite), trinitrotolueno (TNT), trinitrocelulose (algodão pólvora) e ácido pícrico e picrato de amônio;
· É usado na fabricação do salitre (NaNO3, KNO3) e da pólvora negra (salitre + carvão + enxofre);
Pólvora negra: (Salitre - KNO3 + Carvão - C + Enxofre - S)
· As chuvas ácidas em ambientes poluídos com óxidos do nitrogênio contém HNO3 e causam sério impacto ambiental. Em ambientes não poluídos, mas na presença de raios e relâmpagos, a chuva também contém HNO3, mas em proporção mínima;N2(g) + O2(g) → 2 NO(g) + O2(g) → 2 NO2(g) + H2O(l) → HNO2 + HNO3
· O ácido nítrico concentrado é um líquido muito volátil; seus vapores são muito tóxicos. É um ácido muito corrosivo e, assim como o ácido sulfúrico, é necessário muito cuidado para manuseá- lo.
Explosão realizada através do uso do TNT obtido a partir do HNO3
Ø Ácido fosfórico (H3PO4)· Os seus sais (fosfatos) têm grande aplicação como fertilizantes na agricultura;
· É usado como aditivo (acidulante) em refrigerantes como Coca-Cola.

Refrigerante contendo H3PO4 como acidulante
Ø Ácido carbônico (H2CO3)· É o ácido das águas minerais gaseificadas e dos refrigerantes. Forma-se na reação do gás carbônico com a água: CO2 + H2O à H2CO3
· Responsável pelo processo de formação da chuva ácida em ambientes não poluídos na ausência de descargas elétricas.
CO2(g) + H2O(l) Û H2CO3(aq) Û H+(aq) + HCO31-(aq)


Bebidas contendo ácido carbônico (H2CO3)
Ø Ácido acético (H3C-COOH)
· É o ácido constituinte do vinagre, utilizado com condimento na culinária;
· O vinagre é uma solução aquosa contendo de 3 a 7% de ácido acético.
Vinagre contendo 3% a 7% de ácido acético
Fonte:http://www.profpc.com.br/%C3%A1cidos.htm acessado em 26/01/2011

Danilo
ResponderExcluirqueridinha amiga melhore seu texto
beijossssssssssssssssssssssssssss